4.6. Metallide saamine
Metallide saamine maakidest
 Vaata lisandite arvestamise ülesandeid.
Vaata lisandite arvestamise ülesandeid.
Maagist metalli või mittemetalli saamiseks kõigepealt maak peenestatakse ja seejärel rikastatakse. Rikastamine on maagist kõrvaliste ainete eraldamine, kasutades ära maagis sisalduvate ainete füüsikaliste omaduste erinevusi (tihedust, magnetilisi omadusi). Looduslikult leiduvad maagid on keemiliselt väga püsivad, seetõttu peab kulutama metallide tootmisel väga palju energiat. Lihtainena on metallid palju ebapüsivamad kui maagis. Maagis esinevad metallid on positiivse oksüdatsiooniastmega, seetõttu tuleb lihtaine saamiseks ühendeid redutseerida.
 Vaata saagise ja kao ülesandeid.
Vaata saagise ja kao ülesandeid.
Redutseerijana kasutatakse mitmesuguseid aineid: süsinikku, süsinikmonooksiidi, vesinikku või aktiivsemaid metalle nagu Al, Mg, Na jne. Metallidega redutseerimisel saadakse nt kroomi ja mangaani siirdemetalle:
Cr2O3(t) + 2 Al(t) $\xrightarrow{temp}$ 2 Cr(t) + Al2O3(t)
3 Mn3O4 (t) + 8 Al (t) $\xrightarrow{temp}$ 9 Mn(t) + 4 Al2O3(t)
3 MnO2(t) + 4 Al (t) $\xrightarrow{temp}$ 3Mn(t) + 2 Al2O3(t)
Nende kolme reaktsiooni korral näed, et viiakse läbi redutseerumine alumiiniumiga, see on aluminotermia.
Väga paljudel juhtudel kasutatakse redutseerijana süsinikmonooksiidi või süsinikku:
Fe2O3(t) + 3 CO(g) $\xrightarrow{temp}$ 2 Fe(t) + 3 CO2(g)
PbO(t) + CO(g) $\xrightarrow{temp}$ Pb(t) + CO2(g)
ZnO(t) + C(t) $\xrightarrow{temp}$ Zn(t) + CO(g)
Vesinikuga redutseerimisel saadakse väga puhast metalli, vesinikku ei saa kasutada aktiivsete metallide tootmiseks.
Fe2O3(t) + 3 H2(g) $\xrightarrow{temp}$ 2 Fe(t) + 3 H2O(g)
CuO (t) + H2 (g) $\xrightarrow{temp}$ Cu(t) + H2O(g)
Rauda toodetakse rauamaagist särdamisel. Särdamine on kuumutamine õhuhapniku juuresolekul. Selle protsessi tulemusena tekivad oksiidid, metallioksiididest edasi saadakse vaba metall tugevate redutseerijate toimel. Näiteks on pürriit (FeS2) lähteaineks nii raua kui ka väävelhappe tootmisel. Püriidi särdamise teel saadakse raud(III)oksiid (Fe2O3) ja vääveldioksiid (SO2):
4 FeS2 (t) +11 O2 (g) → 2 Fe2O3(t) + 8 SO2(g)
- raua tootmine: 2 Fe2O3(t) + C(t) → Fe (t) + CO2(t)
- väävelhappe tootmine Pt-katalüsaatori juuresolekul:
2 SO2(g) + O2(g) ⇄ 2SO3(g)
SO3(g) + H2O(v) → H2SO4(l)
Metallide toomisel kasutatakse lähteineid, mis sisaldavad lisandeid. Seetõttu on protsessi käigus saadud aine hulk reaktsioonivõrrandi järgi arvutatust väiksem. Reaktsiooni saagis näitab, mitu protsenti moodustab tegelikult saadud reaktsioonisaaduse hulk (või mass) reaktsioonivõrrandi järgi teoreetiliselt arvutatud reaktsioonisaaduse hulgast (või massist). Saagist mõjutavad mitmed tegurid. Üks olulisemaid on kindlasti lisandite hulk maagis. Lisandite hulka saab vähendada maagi rikastamise teel, kuid see ei puhasta lähteaineid täielikult. Metallide tootmise käigus võivad tekkida kaod gaasiliste ainete lendumisel, sademete tekkimisel või ka lisanditest tingitud kõrvalreaktsioonide tõttu. Varasemates peatükkides õppisid, et keemilised reaktsioonid ei kulge sageli lõpuni ehk tekib tasakaaluolek. Ka seetõttu on reaktsiooni saagis arvutatud ainehulgast väiksem.
Ülesande 1 lahendused
1.1. Aluminotermia on metalli tootmine kasutades redutseerijana alumiiniumit. Raua tootmine toimub vastavalt reaktsioonivõrrandile:
Fe2O3 + 2Al → 2Fe + Al2O3.
Mitu kilogrammi alumiiniumit on vaja 5 kg raua tootmiseks? Anna vastus täpsusega üks koht peale koma.
Vastus: 2,4 kg
Lahendus: esmalt leiame raua moolide arvu (teades, et M(Fe) = 56 g/mol = 56 kg/kmol):
\(n(Fe) = {m \over M}= {5kg \over 56kg/kmol}=0.09kmol\)
Reaktsioonivõrrandist näeme, et raua ja alumiiniumi moolsuhe on 2:2=1:1. Seega peab ka alumiiniumi moolide arv olema 0,09 kmol. Teades, et M(Al) = 27 kg/kmol, leiame alumiiniumi massi:
m(Al) = n ×M= 0,09 kmol × 27 kg/kmol = 2,43 ≈ 2,4 kg
1.2. Hematiit sisaldab 3% lisandeid. Mitu kilogrammi hematiiti peab võtma, et saada 1000 kg rauda?
Hematiidi peamine koostisosa on Fe2O3. Raua tootmine toimub vastavalt reaktsioonivõrrandile: Fe2O3 + 2Al → 2Fe + Al2O3. Anna vastus täisarvuna.
Vastus: 1473 kg
Lahendus: esmalt leiame raua moolide arvu (teades, et M(Fe)=56 g/mol=56 kg/kmol):
\(n(Fe) = {m \over M}= {1000kg \over 56kg/kmol}=17.86kmol\)
Reaktsioonivõrrandist näeme, et raua ja Fe2O3 moolsuhe on 2:1. Seega on Fe2O3moolide arv 17,86/2 = 8,93 kmol. Teades, et M(Fe2O3) = 160 g/mol = 160 kg/kmol, leiame selle massi:
m(Fe2O3) = n × M = 8,93 kmol × 160 kg/kmol = 1429 kg
Kuna lisandeid on 3%, on hematiidis puhast Fe2O3 järelikult 97%, mille massi oleme leidnud. 100%-le vastab seega hematiidi mass m = 1429/0,97 = 1473,19 ≈ 1473 kg.
1.3. Mitu grammi alumiiniumit on võimalik saada 350 g boksiidist, mis sisaldab 20% lisandeid?
Al2O3 + 3C → 2Al + 3CO
Anna vastus täisarvuna.
Vastus: 148 g
Lahendus: Boksiidis on lisandeid 20%, seega puhast Al2O3 on 80%. Selle mass on 350×0,8 = 280 g. Leiame Al2O3 moolide arvu (teades, et M(Al2O3)=102 g/mol):
\(n(Al_2O_3) = {m \over M}= {280g \over 102g/mol}=2.745mol\)
Reaktsioonivõrrandist näeme, et Al2O3 ja alumiiniumi moolsuhe on 1:2. Alumiiniumi moolide arv on seega 2×2,745=5,49 mol. Teades, et M(Al) = 27 g/mol, leiame alumiiniumi massi:
m(Al) = n × M = 5,49 mol × 27 g/mol = 148,3 ≈ 148 g
1.4. Pliimaagist (pliiläik PbS) saadi õhu keskkonnas pliioksiid, mis redutseeriti süsiniku abil pliiks:
2PbS + 3O2 → 2PbO + 2SO2
PbO + C → Pb + CO
Mitu grammi pliid saadakse ühest tonnist pliimaagist, kui protsessi saagis on 56%?
Vali õige vastus.
Vastus: 485000 g
Lahendus: antud on pliimaagi mass 1000 kg. Saame selle moolide arvu leida, teades, et M(PbS) = 239 g/mol = 239 kg/kmol:
\(n(PbS) = {m \over M}= {1000kg \over 239kg/kmol}=4.18kmol\)
Pliimaagi ja õhu vahelise reaktsiooni võrrandist näeme, et PbS ja PbO moolsuhe on 2:2=1:1. Seega on ka PbO moolide arv 4,18 kmol. Pliioksiidi ja süsiniku reaktsioonivõrrandist näeme, et PbO ja Pb moolsuhe on 1:1. Seega on ka Pb moolide arv 4,18 kmol. Teades, et M(Pb) = 207 g/mol = 207 kg/kmol, leiame selle massi:
m(Pb) = n × M = 4,18 kmol × 207 kg/kmol = 865,26 kg
Leitud väärtus on plii mass juhul, kui protsessi saagis on 100%. Tegelikult on protsessi saagis vaid 56%, seega tuleb leida 56% arvutatud teoreetilisest plii massist: 0,56×865,26 kg = 484,546 ≈ 485 kg ehk 485000 g.
PS! Saagist võib arvesse võtta ka enne plii massi arvutamist ja korrutada hoopis selle moolide arv 0,56-ga läbi. Siis on leitav mass juba vastav tegelikule plii massile.
Metallide saamine elektrolüüsil
Elektrolüüsi abil toodetakse aktiivsemaid ja vähem aktiivseid metalle.
Elektrolüüs on protsess, kus redoksreaktsioon toimub elektrivoolu toimel. Elektrolüüsil vaadaldakse redutseerumisprotsessi (e- liitmine) ja oksüdeerumisprotsessi (e- loovutamine) eraldi poolreaktsioonidena. Elektrienergia abil on võimalik viia läbi reaktsioone, mis iseeneslikult ei toimu. Elektrolüüsi abil toodetakse kõige aktiivsemaid metalle nagu naatrium, kaalium, magneesium.
Allikas: https://youtu.be/d_qZ0uuhQCY
Elektrolüüs viiakse läbi elektrolüüsilahuse või sulatatud elektrolüüdiga täidetud elektrolüüsianumas (vaata joonist 1). Elektrolüüs toimub elektrolüüsivanni paigutatud elektroodidel.
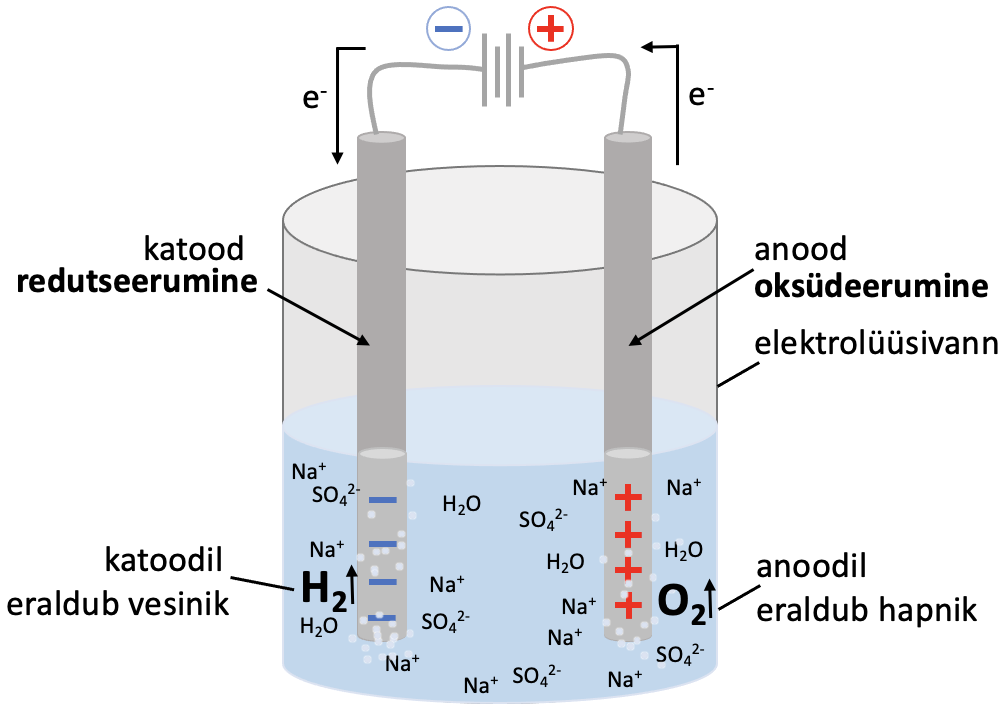
Joonis 1. Elektrolüüsi protsessi põhiskeem
Katood. Alalisvoolu toimel varustatakse katoodi negatiivselt laetud elektronidega, seetõttu laadub katood negatiivselt. Katoodil saab toimuda seega elektronide liitmine ehk redutseerumine. Reaktsioon katoodil sula NaCl näite põhjal:
Na+ + e-→ Na
Anood. Anoodilt tõmmatakse alalisvoolu toimel elektrone ära, seetõttu laadub anood positiivselt. Seega on anoodil elektronide puudujääk. Anoodil toimub elektronide loovutamine ehk oksüdeerumine. Reaktsioon anoodil sulatatud NaCl näite põhjal:
2 Cl- - 2 e-→ Cl2
Elektroodil toimuvat reaktsiooni nimetatakse poolreaktsiooniks. Elektrolüüsiprotsessi summaarse reaktsiooni saame kahe poolreaktsiooni liitmisel:
 Na+ + e-→ Na - reaktsioon katoodil |×2
Na+ + e-→ Na - reaktsioon katoodil |×2 2 Cl- - 2 e-→ Cl2 - reaktsioon anoodil
2 Cl- - 2 e-→ Cl2 - reaktsioon anoodil
____________________________________________
2 Na+ + 2 Cl- $\xrightarrow{elektrolüüs}$ 2 Na + Cl2
Pane tähele, et siin on katoodi poolreaktsioon korrutatud kahega, sest oksüdeerumisel ja redutseerumisel peab elektronide arv olema võrdne.
Elektroodidel toimuvate poolreaktsioonide tõttu tekib elektrivool ja elektronid liiguvad anoodilt katoodile. Lahuses kannavad voolu ioonid: negatiivsed ioonid (anioonid) liiguvad anoodile ning positiivsed ioonid (katioonid) liiguvad katoodile.
Toome kaks näite elektrolüüsist.
Aktiivsete metallide saamine elektrolüüsil
Naatriumi saadakse sulatatud NaCl elektrolüüsil. Lisaks naatrumile saab selle protsessi tulemusena kloori. Lähteaineks on NaCl. Sulatamisel laguneb NaCl kergesti liikuvateks Na+ ja Cl- ioonideks. Elektrolüüsil toimuvad poolreaktsioonid ja summaarne reaktsioon on toodud eespool.
Väheaktiivsete metallide saamine elektrolüüsil
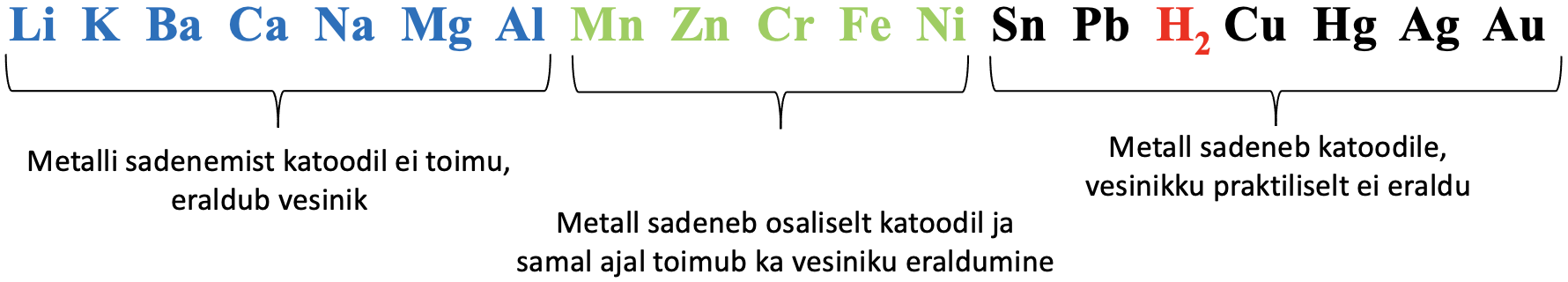
Väheaktiivseid metalle nagu Cu, Ag, Au, Sn, Pb (vaata ka alumist joonist) saab toota vastava soola vesilahuse elektrolüüsil.
Tahke vask(II)sulfaadi lahuses on vask(II)ioonid ja sulfaatioonid:
CuSO4→ Cu2+ + SO2-4.
Voolu läbijuhtimisel lahusest liiguvad negatiivsed sulfaatioonid positiivsele elektroodile (anoodile) ja positiivsed Cu2+ - ioonid negatiivsele elektroodile (katoodile). SO42--ioonis on väävlil maksimaalne oksüdatsiooniaste – sulfaatioon ei saa oksüdeeruda, selle asemel hakkab anoodil lagunema vesi.
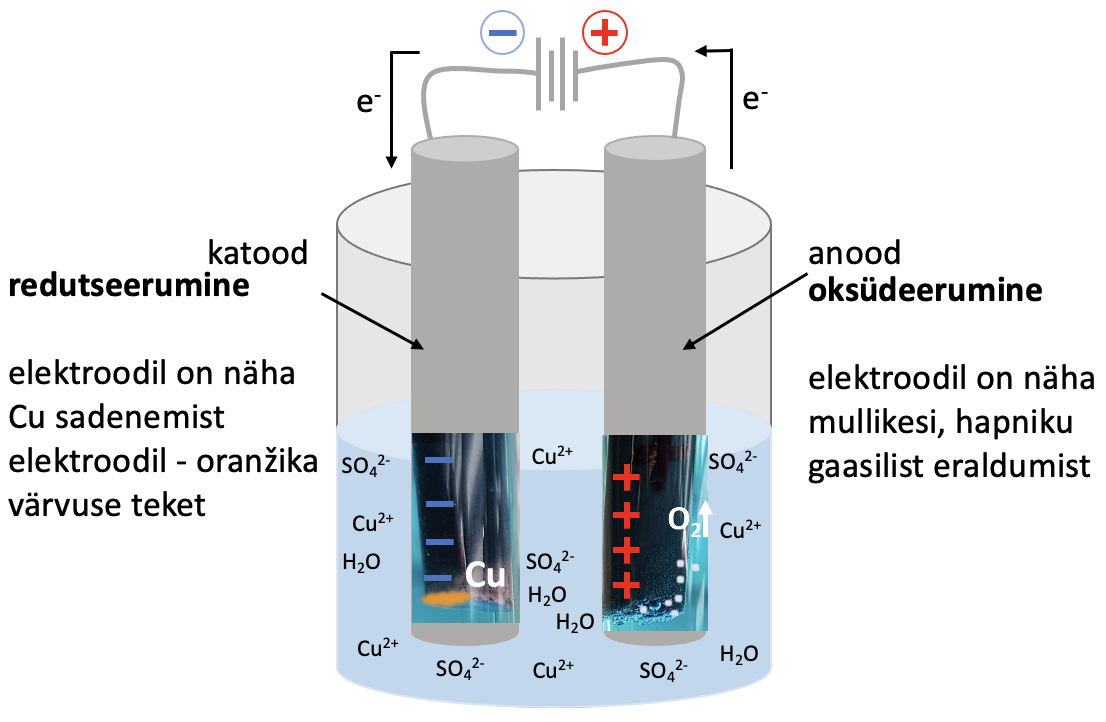
Joonis 2. Väheaktiivsete metallide saamine elektrolüüsil. Joonisel on vase saamine elektrolüüsil vask(II)sulfaadi vesilahusest
 Cu2+ + 2 e- → Cu |×2
Cu2+ + 2 e- → Cu |×2 2 H2O- 4 e- → О2 + 4 H+
2 H2O- 4 e- → О2 + 4 H+
____________________________________________
2 Cu2+ + 2H2O $\xrightarrow{elektrolüüs}$ 2 Cu + О2 + 4 H+ – saame summaarse võrrandi ioonsel kujul.
Molekulaarsel kujul reaktsiooni esitades tuleb arvestada ka sulfaatioone:
2 CuSO4+ 2 H2O $\xrightarrow{elektrolüüs}$ 2 Cu + О2 + 2 H2SO4
Ülesande 2 lahendused
2.14. Mitu grammi kaltsiumbromiidi peab võtma, selleks, et sulatatud soola elektrolüüsil tekiks 5 grammi kaltsiumit? Anna vastus täisarvuna.
Elektrolüüsi võrrand: CaBr2 → Ca + Br2
Vastus: 25 g
Lahendus: antud on kaltsiumi mass 5 g. Saame selle moolide arvu leida, teades, et M(Ca) = 40 g/mol:
\(n(Ca) = {m \over M}= {5g \over 40g/mol}=0.125mol\)
Reaktsioonivõrrandist näeme, et kaltsiumi ja CaBr2 moolsuhe on 1:1. Seega peab võtma 0,125 mol kaltsiumbromiidi. Teades, et M(CaBr2) = 200 g/mol, leiame selle massi:
m(CaBr2) = n × M = 0,125 mol × 200 g/mol = 25 g
2.15. Mitu grammi pliikloriidi peab võtma, selleks, et sulaelektrolüüsil tekiks 5 grammi pliid, kui elektrolüüsiks võetud sool sisaldas 10% lisandeid?
Sula elektrolüüsi võrrand PbCl2 → Pb + Cl2
Anna vastus üks koht peale koma.
Vastus: 7,4 g
Lahendus: antud on plii mass 5 g. Saame selle moolide arvu leida, teades, et M(Pb) = 207 g/mol:
\(n(Pb) = {m \over M}= {5g \over 207g/mol}=0.024mol\)
Reaktsioonivõrrandist näeme, et plii ja PbCl2 moolsuhe on 1:1. Seega peab võtma 0,024 mol pliikloriidi. Teades, et M(PbCl2) = 278 g/mol, leiame selle massi:
m(PbCl2) = n × M = 0,024 mol × 278 g/mol = 6,67 g
See on puhta PbCl2 mass. Elektrolüüsiks võetud sool sisaldas aga 10% lisandeid lisaks puhtale PbCl2-le, seega puhta PbCl2 mass on 90% soola koostisest. Seega tuleb soola võtta 6,67/0,9 = 7,41 ≈ 7,4 g.

